2003擭傑偱偼栤戣偼塸岅偱塸岅偺帿彂偺傒帩崬壜偱偡丅塸岅偺壓偺擔杮岅偼忋偺塸暥偺栿偱幚嵺偺僥僗僩偵偼偁傝傑偣傫丅
2004擭偐傜嫵壢彂偑擔杮岅偺嫵壢彂偵曄傢偭偨偨傔丄栤戣傕擔杮岅偵側偭偰偄傑偡丅
2006擭偐傜彫郪嫵姱偵戙傢傝傑偟偨丅彫郪嫵姱偼愢柧栤戣偑傎偲儞偳偱丄拞娫偼惉愌偵偼偁傑傝娭學側偔丄婜枛偺亄兛掱搙偺傛偆偱偡丅
仠婎慴柍婡壔妛丂俫19/07/31丂嘦晹丂彫郪嫵姱丂婜枛丂丂丂丂丂丂仼乮俫18擭偺婜枛傕摨偠栤戣偱偟偨乯
丂侾. 儊僞儞丄傾儞儌僯傾丄悈偺暘巕偺乮俫-倃-俫丗倃偼俠丒俶丒俷乯偑側偡妏搙偼偦傟偧傟109.3亱丄107.5亱丄104.5亱偱偁傞丅
丂丂偙偺偲偒丄側偤偦傟偧傟偑堘偆妏搙偵側傞偺偐棟桼傪愢柧偣傚丅
丂俀丏壓恾偼丄戞堦僀僆儞壔僄僱儖僊乕偲尨巕斣崋偺娭學傪昞偟偨恾偱偁傞丅埲壓偺栤偵摎偊側偝偄丅
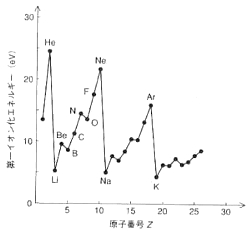 侾乯婓僈僗偼尨巕斣崋偑戝偒偄傎偳僄僱儖僊乕偼彫偝偄丅
侾乯婓僈僗偼尨巕斣崋偑戝偒偄傎偳僄僱儖僊乕偼彫偝偄丅俀乯俛e仺俛丄俶仺俷偲僀僆儞壔僄僱儖僊乕偼尭彮偡傞丅
丂丂丂丂丂
丂俁丏巁慺暘巕偺揹巕攝抲偵偮偄偰俀s俀p婳摴偵娭偡傞暘巕婳摴僄僱儖僊乕忬懺傪恾帵偣傛丅
丂丂丂傑偨丄忢帴惈偱偁傞偐偳偆偐偲寢崌師悢傪媮傔傛丅
丂係丏摵(嘦)偺嶖懱
丂
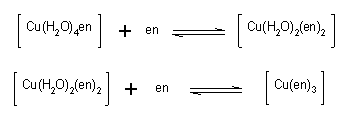
仠婎慴柍婡壔妛丂俫19/07/06丂嘦晹丂彫郪嫵姱丂拞娫丂丂丂丂丂丂仼乮俫18擭偺拞娫傕摨偠栤戣偱偟偨乯
丂侾丏慡偰偺倓婳摴傪偟偨偺俹倶婳摴偺椺偵側傜偭偰丄偦傟偧傟恾帵偟丄埵憡傪乬亄乭丄乬亅乭偲偟偰婰偣丅
丂丂丂偨偩偟丄嵗昗幉偼娭楢偺偁傞傕偺偺傒婰偣偽椙偄丅
丂丂乮椺乯俹倶
丂丂丂丂
丂俀丏儊僞儞暘巕丄傾儞儌僯傾暘巕丄悈暘巕偺乮俫-倃-俫丗倃偼俠丒俶丒俷乯偑側偡妏搙偼偳偺傛偆側弴斣偵側傞偐丅
丂丂丂戝偒偄弴偵晄摍崋傪梡偄偰婰偣丅偦偺棟桼傪VSEPR乮尨巕壙妅揹巕懳斀敪棟榑乯棟榑傪梡偄偰愢柧偣傛丅
丂俁丏俫俀暘巕偲俫e俀暘巕偑偦傟偧傟懚嵼壜擻偐偳偆偐偵偮偄偰暘巕婳摴朄傪梡偄偰愢柧偣傛丅
丂係丏俷俀暘巕偺揹巕攝抲偵偮偄偰俀s俀p婳摴偵娭偡傞暘巕婳摴僄僱儖僊乕忬懺乮壓婰恾嶲徠乯傪恾帵偣傛丅
丂丂丂傑偨丄偦偺寢崌師悢偼偄偔偮偐丠嶼弌曽朄傪柧婰偟偰愢柧偣傛丅
丂丂丂丂
仠婎慴柍婡壔妛丂俫18/07/13枠丂嘦晹丂彫郪嫵姱丂儗億乕僩
丂侾丏捠忢尨巕婳摴偼庡検巕悢値偱僄僱儖僊乕偑婯掕偝傟傞偑丄幚嵺偵偼俀s婳摴傛傝傕俀p婳摴偺傎偆偑僄僱儖僊乕偑崅偄丅
丂丂丂丂偙傟偵偮偄偰尨巕婳摴偺乬娧擖乭偲乬桳岠妀揹壸乭偐傜愢柧偣傛丅
丂俀丏師偺嶖懱柤偐傜壔崌暔偺慻惉幃偲峔憿傪婰偣丅傑偨丄婔壗堎惈懱偁傞偄偼岝妛堎惈懱偑偁傞応崌偵偼偦偺峔憿傕婰偣丅
丂丂侾乯價僗僠僆僔傾僫僩僥僩儔傾儞儈儞僐僶儖僩乮III乯丂丂丂丂丂丂丂丂僌儕僔僫僩
丂丂俀乯僕僋儘儘價僗僄僠儗儞僕傾儈儞僐僶儖僩乮III乯
丂丂俁乯僩儕僗僌儕僔僫僩僐僶儖僩乮III乯丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂
仛柍婡壔妛嘥丂2004/2/13 婜枛丂憹揷嫵姱
丂侾丏悈慺暘巕偑側偤慄僗儁僋僩儖傪帵偡偺偐丠
丂俀丏棫曽偍傛傃榋朄僷僢僉儞僌偵偮偄偰愢柧偣傛丅偝傜偵嬻岴傪傕偪偄偨嬥懏壔崌
丂丂丂暔偺傂偲偮傪婰偟愢柧偣傛
丂俁丏師偺岅嬪傪愢柧偣傛
丂丂侾丂僗僺儞懡廳搙
丂丂俀丂桳岠妀揹壸
丂丂俁丂尨巕壙揹巕懳斀敪(VSEPR)
丂丂係丂儅乕僨儕儞僌掕悢
丂係丏僀僆儞寢崌丂嫟桳寢崌丂嬥懏寢崌偺堘偄傪揹巕枾搙偺堘偄偐傜愢柧偣傛
仛柍婡壔妛嘥丂2003/2? 婜枛丂憹揷嫵姱
丂侾丏Explain the hexagonal and cubic close-packing structures, and describethe perovskite in CaTiO3.
丂丂丂乮棫曽嵟枾僷僢僉儞僌丄媦傃榋曽嵟枾僷僢僉儞僌傪愢柧偣傛丅傑偨丄儁儘僽僗僉乕宆峔憿傪恾帵偣傛丅乯
丂俀丏Many oxoanions can act as ligands in more than one way.Give the ways for(a)CO32- (b)SO42- (c)NO3- (d)CH3CO2- (e)NO2-
丂丂丂乮懡偔偺僆僉僜僯僂儉僀僆儞偼堦捠傝埲忋偺攝埵巕偺傛偆偵摥偔丅埲壓偺(a)(b)(c)(d)(e)偺僆僉僜僯僂儉僀僆儞偺攝埵巕傪婰偣丅乯
丂俁丏Draw structures for cyclic and linear condensed phoshates.
丂丂丂乮娐忬媦傃捈慄宆弅崌儕儞巁偺峔憿傪彂偗丅乯
丂係丏State the Lewis difinition of acid and bases.
丂丂丂乮儖僀僗偺巁丄墫婎偺掕媊偵偮偄偰婰弎偣傛丅乯
仛柍婡壔妛嘥丂2002/? 拞娫 憹揷嫵姱
丂侾丏Draw diagrams of each of the following orbitals:1s,2px,2py,2pz,3dz2,3dxy,3dyz,3dzx,3dx2-y2.
丂丂丂乮師偺婳摴偺偦傟偧傟偺恾傪偐偗丅乯
丂俀丏Why is the first ionization enthalpy of the oxygen atom lower than丂that of the nitrogen atom?
丂丂丂乮拏慺尨巕傛傝巁慺尨巕偺傎偆偑戞堦僀僆儞壔僄儞僞儖僺乕偑掅偄偺偼側偤偐丠乯
丂丂丂
丂俁丏What doesthe term "electron deficient molecule" mean?丂
丂丂丂乮揹巕晄懌暘巕偲偄偆岅偼壗傪堄枴偡傞偐丅乯
丂係丏For the series of diatomics O2+, O2, O2- and O22-, determine from an MO energylevel diagram how the bond lengths will
丂丂丂 vary and how many unpaired electrons each should have.
丂丂丂乮俀尨巕暘巕偺宯楍 OO2+, O2, O2- O22-,偵懳偟偰丄偦偺寢崌嫮搙偑偳偺傛偆偵曄傢傞偐丄傑偨偦傟偧傟偑丄晄懳揹巕偄偔偮傪傕偭偰偄丂丂丂丂丂傞偼偢偐傪MO僄僱儖僊乕弨埵恾偐傜寛掕偣傛丅乯
仛柍婡壔妛嘥丂2001/2/4 婜枛丂憹揷嫵姱
丂侾丏Explain the hexagonal and cubic close-packing structures, and describe the perovskite in CaTiO3.
丂丂丂乮棫曽嵟枾僷僢僉儞僌丄媦傃榋曽嵟枾僷僢僉儞僌傪愢柧偣傛丅傑偨丄儁儘僽僗僉乕宆峔憿傪恾帵偣傛丅乯
丂俀丏Many oxoanions can act as ligands in more than one way. Give the ways for(a)CO32- (b)SO42- (c)NO3- (d)CH3CO2- (e)NO2-
丂丂丂乮懡偔偺僆僉僜僯僂儉僀僆儞偼堦捠傝埲忋偺攝埵巕偺傛偆偵摥偔丅埲壓偺(a)(b)(c)(d)(e)偺僆僉僜僯僂儉僀僆儞偺攝埵巕傪婰偣丅乯
丂俁丏In the following series of electronically saturated and isoelectronic ions, the observed X-O band distances have been
丂丂丂determined as follows; 1.36侌 for SiO44-, 1.54侌 for PO43-, 1.49 for SO42-, 1.46侌 for ClO4-
丂丂丂乮師偺揹巕揑朞榓忬懺偺摍揹壔僀僆儞偵偮偄偰丄娤應偵傛傝X-O偺寢崌嫍棧偑師偺傛偆偵寛掕偝傟偨丅偙傟傜偺寢崌嫍棧偺堘偄偵偮偄偰
丂丂丂丂丂愢柧偣傛丅乯
丂係丏State the Lewis difinition of acid and bases.
丂丂丂乮儖僀僗偺巁丄墫婎偺掕媊偵偮偄偰婰弎偣傛丅乯